第一三共さんから乳がん治療薬として承認された話題の新薬エンハーツ。
2020年9月25日には胃がんの適応も承認になりました。
《朗報》
— 日本がん対策新聞 (@gantaisaku1105) September 25, 2020
【HER2陽性胃がん:三次治療】25日、「エンハーツ」が「がん化学療法後に増悪したHER2陽性の治癒切除不能な進
行・再発の胃癌」を効能・効果として承認された。DESTINY-Gastric01試験などの結果に基づく。https://t.co/7k09346KwL
エンハーツは第一三共さんが社運を賭けている薬剤だそうで世界から注目が集まっているようですね。
第一三共が社運を賭けて開発したエンハーツが日本でも発売されました。まず乳がんのサードラインでの適応ですが、より早期、HER2低発現のもの、他のがん種への適応拡大も急がれています。副作用の間質性肺炎のマネジメントに気をつけつつ、超大型品に育て上げたい製品です。https://t.co/yTqrek3eFV
— omoromen (@omoromen) May 25, 2020
エンハーツはすでにILD(間質性肺疾患)が重要な特定されたリスクになっていますが、胃がんでは乳がんより投与量が高用量となっていて、副作用は本当に大丈夫?と気になるところ。
今回は胃がん適応追加のきっかけとなった臨床試験の結果から、改めてエンハーツの効果・副作用に注目したいと思います。
【この記事を書いた人】

病院薬剤師です。DI関連のお仕事でちょこちょこ新薬の情報を集めています。
エンハーツの胃がんに対する効果

胃がんにおける臨床効果を検証した試験(DESTINY-Gastric01)がこちら。
(Full Text読みたいのですが私のいる環境ではAbstractしか読めないのでご了承ください^^;)
エンハーツの審査報告書では第Ⅱ相の中間結果までだったのでこれが最終結果となります。
対象:トラスツズマブを含む二つ以上の化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発胃がん患者(エンハーツ群とCPT-11 or PTX群を2:1で割付け)
デザイン:非盲検無作為化比較試験の主要コホート
主要評価項目:RECIST ver.1.1 に基づくICR 判定による奏効率
主要解析において統計学的に有意な結果が得られた場合には、副次評価項目の一つとされた PFS、OS の順に階層的に解析を実施
結果はみごとに有意差をもってエンハーツ群の勝利。
An objective response was reported in 51% of the patients in the trastuzumab deruxtecan group, as compared with 14% of those in the physician’s choice group (P<0.001). Overall survival was longer with trastuzumab deruxtecan than with chemotherapy (median, 12.5 vs. 8.4 months; hazard ratio for death, 0.59; 95% confidence interval,
https://pubmed.ncbi.nlm.nih.gov/32469182/
エンハーツの奏効率は51%(対照群は14%)、全生存は12.5か月(対照群は8.4か月)
3次治療でここまでの奏効率は今までなかったのではないかと思います。
第Ⅱ相試験の結果とはいえ、この結果をもって承認となったのは納得できますね。
エンハーツの臨床的な位置づけ
審査報告書に書かれている臨床的な位置づけについて紹介します。
トラスツズマブを含む二つ以上の化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の胃癌患者における3次治療は確立されていません。
DESTINY-Gastric01試験が始まった当初はPac, CPT-11くらいしか選択肢がありませんでした。
機構としては、既存のオプジーボ、ロンサーフ等との使い分けについては不明としながら、エンハーツ以外の治療の実施についても慎重に検討した上で、投与の可否を判断する必要がある、としています。
エンハーツ点滴静注用(胃癌)_第一三共株式会社_審査報告書P18
現時点では、3次治療の段階でエンハーツへの忍容性があるかどうかで判断しなさい、ということですね。
エンハーツの投与量~胃がんと乳がんで用量が異なるわけ~

エンハーツの胃がん用量は6.4mg/kgで、乳がんの5.4mg/kgより高用量になっています。
この理由は審査報告書P19で次のように記載されています。

6.4mg/kgは効果が高く、有害事象が多いもののマネジメント可能という判断です。
エンハーツの副作用〜胃がん患者〜
高用量ということで、副作用が気になります。
DESTINY Gastric01試験では
The most common adverse events of grade 3 or higher were a decreased neutrophil count (in 51% of the trastuzumab deruxtecan group and 24% of the physician’s choice group), anemia (38% and 23%, respectively), and decreased white-cell count (21% and 11%). A total of 12 patients had trastuzumab deruxtecan–related interstitial lung disease or pneumonitis (grade 1 or 2 in 9 patients and grade 3 or 4 in 3), as adjudicated by an independent committee. One drug-related death (due to pneumonia) was noted in the trastuzumab deruxtecan group; no drug-related deaths occurred in the physician’s choice group.
https://pubmed.ncbi.nlm.nih.gov/32469182/
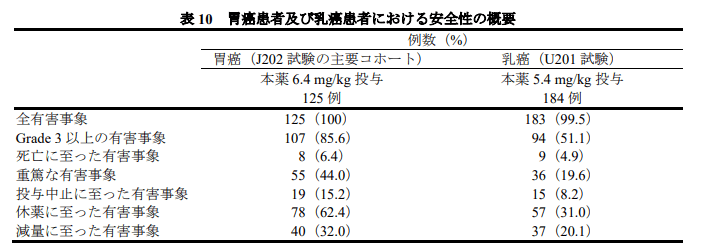
- Grade3以上の好中球減少症は51%(対照群は24%)、貧血は38%(対照群は23%)に出現
- ILD(間質性肺疾患)は125人中12人に出現(Grade1,2は9人、Grade3,4は3人)
- 肺炎で1人が死亡(対照群は0)
と記載されています。
乳がんで特定されたリスク同様、好中球減少症とILDには注意が必要と言えます。
審査報告書では

曝露量が増加するにしたがってILDの発現率が高くなることが記載されています。
また、胃がん患者と乳がん患者との副作用の比較でも、胃がん患者のほうが有害事象の頻度が高いことが分かります。
高用量投与することにより、ILDを含む骨髄抑制等の有害事象には注意すべきでしょう。
日本消化器学会もILDに注意喚起
これを受けて日本消化器学会のエンハーツ適正使用推進委員会、第一三共から「エンハーツ®点滴静注用 100mg適正使用へのご協力のお願い(胃癌)」が発出されています。
施設用件としては
- 投与期間中、初期症状の確認や定期的な SpO2検査、胸部X線検査及び胸部CT検査の実施を
- ILD の診断及び治療においては、呼吸器疾患に精通した医師との連携を
製造販売後はILDの発現状況及びそのリスク因子について検討するため全例調査、とすることも承認用件となっており、徹底したリスク管理がされていますね。
また乳がん同様にCOVID-19流行下ではILDとの鑑別が難しいため注意が必要です。
【関連記事】審査報告書・RMPからみる「エンハーツ点滴静注」(トラスツズマブ・デルクステカン)
メーカーとの情報提供手段は施設の要望に応じて面会又はオンライン会議ツールを用いること、と記載されているのは今どきですね。
なお、RMP(医薬品リスク管理計画)は乳がんの時と変更ありません。
まとめ
エンハーツの胃がん用量における副作用、特にILDについてまとめました。
個人的には効果がある反面、胃がんの3次治療にしてはかなり強めの副作用という印象です。
今後3次治療以前のラインナップになってくる可能性もあるとは思いますが、乳がんの審査報告書ではILDが日本人に多い傾向にありましたので、同様の傾向もしくはそれ以上の頻度で出現しないかは注意していく必要がありますね。
(RMPがしっかり機能していますので、そのあたりは適切にモニタリングされるはずですが)
エンハーツが多くの胃がん患者さんに恩恵がえられるよう、私たち薬剤師も積極的に治療に参加していきたいと思います。




コメント