このページの要点は以下のとおりです。
・膵がん治療薬としてリポ化したイリノテカン製剤が承認された
・オニバイド/5-FU/LVレジメンはGEMを含む一次治療後に増悪した遠隔転移を有する膵がんに対する二次治療以降の選択肢
・投与量は遺伝子多型に基づいて決定
本日は膵癌治療薬の「オニバイド」についてです。
日本セルヴィエ株式会社(海外で活躍されている企業でしょうか)が販売しています。

オニバイドってなかなかのネーミング。。
でもなぜいま、イリノテカン??

ネーミングに深い意味はないらしいよ、、、
海外の名称をそのまま持ってきたみたい。
「リポソーマル製剤にしたイリノテカン」だから新薬だよ。
リポソーマル製剤とは?

リポソーマル製剤は、体内で必要な量の薬を、必要な部位に、必要な時間運ぶ技術 Drug delivery system(DDS)に基づいて作られた薬剤です。
「リポ」は脂質、「ソーム」は袋を意味します。脂質の袋の中に入ったイリノテカンが徐々に体内に放出されることによって、長時間にわたり作用が持続します。

リポ化したことでイリノテカンの半減期は2.75倍、活性代謝物であるSN38の半減期は4倍になってました。(審査報告書P20)
有効性

海外第Ⅲ相試験(NAPOLI-1試験)の結果をもとに評価しています。
対象:GEMを含む化学療法後に増悪した遠隔転移を有する膵癌患者
デザイン:非盲検無作為化比較試験
主要評価項目:オニバイド/5-FU/LV 3剤併用、オニバイド単独投与、5-FU/LV 2剤併用レジメンの全生存期間(OS)の比較
※もともとは5-FU/LV 群に対するオニバイド単独群の優越性を検証する試験でしたが、途中から3群レジメンの比較試験に変更になっています
結果は以下のとおりです。
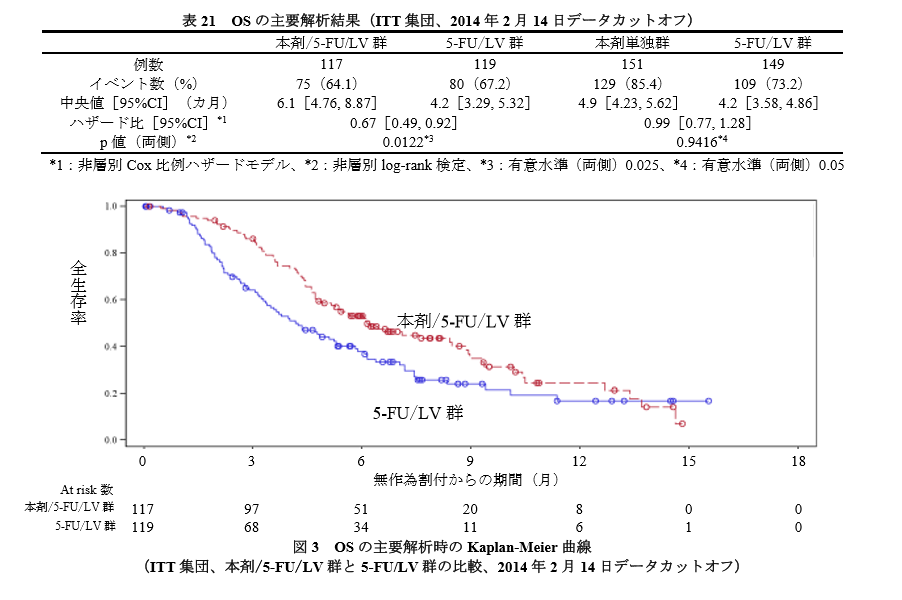
5-FU/LV 群に対するオニバイド/5-FU/LV 群の優越性が認められています。
生存期間の中央値の差は約2か月です。
一方、 5-FU/LV 群に対するオニバイド単独群の統計学的に有意なOSの延長は認められませんでした。
ちなみに、日本人を対象とした国内第Ⅱ相試験(331501試験)では主要評価項目である無増悪生存期間(PFS)の延長はみられていませんが、延長する傾向があること、奏効率(CR+PR)が17.5%あった等の点が評価されています。
安全性

オニバイドの医薬品リスク管理計画書(RMP)です。
※2020年5月28日時点では、まだ(案)となっています

以下、審査報告書P31-50 を参考に副作用を確認します。
骨髄抑制
NAPOLI-1試験ではオニバイド/5-FU/LVレジメンで 3人に1人、331501試験では2人に1人がGrade3以上の骨髄抑制を経験していることに注意が必要です。
日本人では外国人と比べて、好中球数減少、白血球数減少の発現率が高いものの忍容可能な範囲だろうと判断されています。
下痢
NAPOLI-1試験、331501試験いずれもオニバイド/5-FU/LVレジメンで約60%が下痢を経験していますが、Grade3以上は15%程度でした。
意外とGrade3以上の下痢がコントロールされている印象を受けました。
この背景は、遺伝子多型を考慮した投与量に基づいて試験が実施されたため,あるいはリポ化製剤にした影響?があるのかもしれません。
infusion reaction
リポ化したことの影響があるのかないのか記載がなく不明ですが、NAPOLI-1試験では注入に伴う反応、331501試験では発疹が主に出現していました。
全体の頻度としては抗体製剤によるinfusion reactionより圧倒的に少なく、抗ヒスタミン薬などの前投薬などの対策は必要なさそうです。
その他
その他の副作用については既知のリスクを超えるものはなさそうです。

イリノテカンと言えば、早発性下痢に対する抗コリン薬の前投薬、遅発性下痢に対する止瀉薬の投与が有名ですが、リポ化したことでこれらの副作用の頻度や対策に変化があるのか?については個人的に興味があるところ。今後の報告を待ちたいと思います。
臨床的位置づけ
審査報告書P51-52の記載です。
・オニバイドは一次治療における有効性及び安全性は確立していない。
・オニバイドの術後補助療法における有効性及び安全性は確立していない。
・オニバイド/5-FU/(l-)LV と他の抗悪性腫瘍剤(FOLFIRINOX 療法等)との使い分けについては、有効性及び安全性を比較した臨床試験成績は得られていないことから、現時点ではいずれの薬剤を優先すべきかに関しては不明

一次治療で選択したレジメンや患者さんの年齢・体力などを考慮して、二次治療でオニバイド/5-FU/LV療法が選択されるケースは一定数ありそうですね。
遺伝子多型に基づいた投与量設定
オニバイドを使用する際は、重篤な下痢や骨髄抑制が出現するおそれのあるため、事前に遺伝子型(UGT1A1)を調べておく必要があります。(注:投与前の遺伝子検査が必須かどうかは添付文書を確認するまで分かりません)
→添付文書では以下の記載になりました。
臨床試験に組み入れられた患者の病期、前治療歴、 UGT1A1注)遺伝子多型等について、「17.臨床成績」の項の 内容を熟知し、本剤の有効性及び安全性を十分に理解した 上で、適応患者の選択を行うこと。
UGT1A1*6 若しくはUGT1A1*28 のホモ接合体を有する患者、又はUGT1A1*6 及びUGT1A1*28 のヘテロ接合体を有する患者
⇒ (通常70mg/㎡のところ)イリノテカンとして1 回50mg/m2を開始用量とする。

遺伝子検査をもとに投与量が決定されるというのは、まさに個別化治療と言えますね。がん治療の進歩を感じます。
まとめ
膵臓がんは他のがん腫に比べると治療の選択肢が少ない領域だったので、オニバイドの登場は喜ばしいです。販売後にリポ化製剤特有の副作用がないかについては注視していきたいと思います。
・膵がん治療薬としてリポ化したイリノテカン製剤が承認された
・オニバイド/5-FU/LVレジメンはGEMを含む一次治療後に増悪した遠隔転移を有する膵がんに対する二次治療以降の選択肢
・投与量は遺伝子多型に基づいて決定
・新薬について自分で勉強してみたい、医薬品の評価をしてみたい人にはこちらの本がおすすめです。初心者にも分かりやすいですよ。






コメント