このページの要点は以下のとおりです。
・オゼンピックは週1回のGLP-1作動薬
・単独療法でも経口DM薬、インスリンとの併用療法でも有効性が確認されている
・トルリシティに比べて効果が高いことが検証されている(SUSTAIN7)
・副作用の忍容性の高さから今後GLP-1作動薬の主流になるかも
今回はGLP-1作動薬のオゼンピック皮下注です。
実はこの薬、2018年3月に「オゼンピック皮下注2mg」として承認されています。

しかし、2mg製剤は維持量0.5mg/週×4回分となり、新薬14日制限に抵触してしまうため、薬価収載が見送り、という経緯があったようです。
それでは審査報告書・RMPをみていきましょう。
オゼンピックの特徴
オゼンピックは、ヒト由来のGLP-1という酵素をもとに構造を改変した薬(ヒトGLP-1アナログ)です。
GLP-1 は、小腸から分泌されるインクレチンホルモンで、血糖値が高くなるとインスリン分泌を促進し、血糖を下げる作用があります。
オゼンピックは、アルブミンを結合しやすくしたことと、アミノ酸を改変したことによってDPP-4酵素による分解がされにくくなっています。
そのため、持続性が高く週1 回皮下投与であることが特徴です。
競合製品については後ほど解説しますね。

今回、1回使いきりのペン型製剤とし、規格を3つそろえたことで14日制限問題が解決されています。
有効性

国内第III相単独療法試験(4092試験 SUSTAIN-Japan monotherapy)
対象:食事・運動療法又は食事・運動療法に加え経口血糖降下薬1剤による治療で十分な血糖コントロールが得られていない日本人2型糖尿病患者
デザイン:シタグリプチンを対照とした無作為化非盲検並行群間比較試験
主要評価項目:ベースラインから投与30週時までのHbA1c変化量
結果です。
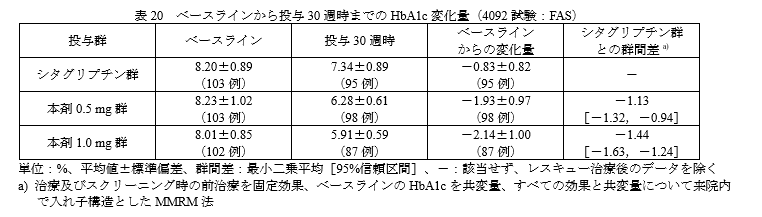
シタグリプチンと比較してHbA1cを1%近く改善しています。
国内第III相単独及び併用療法長期投与試験(4091試験 SUSTAIN-Japan OAD combination)
対象:食事・運動療法又は食事・運動療法に加え経口血糖降下薬1剤による治療で十分な血糖コントロールが得られていない日本人2型糖尿病患者
デザイン:実薬対照無作為化非盲検並行群間比較試験(本剤の単独療法及び経口血糖降下薬(SU、グリニド、α-GI、チアゾリジンのいずれか)との併用療法
主要評価項目:ベースラインから投与56週時までのHbA1c変化量
結果です
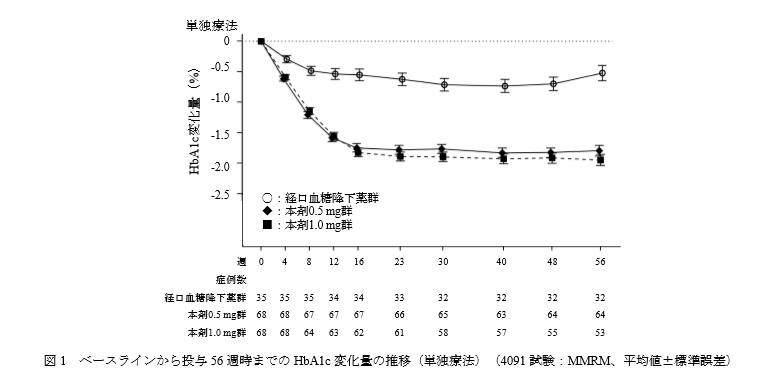
単独療法において、オゼンピック群は経口血糖降下薬群と比較してHbA1cを1%近く低下させています。
こちらは経口血糖降下薬との併用療法の結果です。
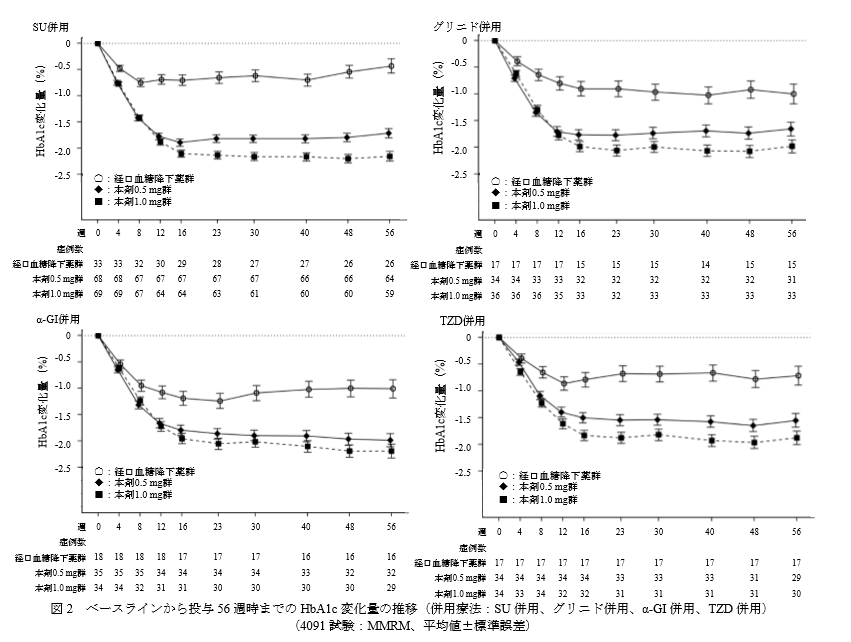
血糖降下薬2剤併用に比べ、血糖降下薬1剤+オゼンピック併用群のほうがどの薬剤との併用でもHbA1c低下効果があることが分かります。
国際共同第III相単独療法試験(3623試験 SUSTAIN1)
対象:食事・運動療法で十分な血糖コントロールが得られていない2型DM患者
デザイン:プラセボ対照無作為化二重盲検並行群間比較試験
主要評価項目:FASにおけるベースラインから投与30週時までのHbA1c 変化量
結果です。

プラセボ群とオゼンピック群との群間差は、0.5mg群では-1.43[-1.71, -1.15]%、1.0mg 群では-1.53[-1.81, -1.25]%であり、オゼンピックのプラセボ群に対する優越性が示されました。
国際共同第 III 相併用療法長期投与試験(3626試験 SUSTAIN2)
対象:BG及び/又は TZDで十分な血糖コントロールが得られていない 2 型糖尿病患者
デザイン:シタグリプチンを対照とした無作為化二重盲検並行群 間比較試験
主要評価項目:FASにおけるベースラインから投与56 週時までのHbA1c変化量
結果です。
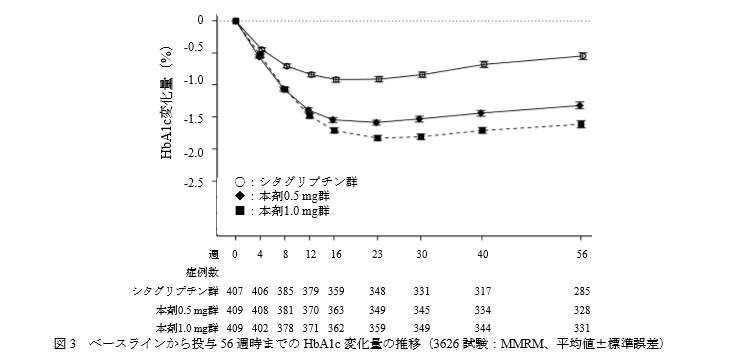
長期併用においても、オゼンピック群のシタグリプチン群に対する非劣性が示されました。
国際共同第 III 相インスリン併用試験(3627試験 SUSTAIN5)
・対象:基礎インスリンまたは基礎インスリン+BGの併用で十分な血糖コントロールが得られていない2型糖尿病患者
・デザイン:プラセボ対照無作為化二重盲検並行群間比較試験
・主要評価項目:FASにおけるベースラインから投与30週時までのHbA1c変化量
結果です。
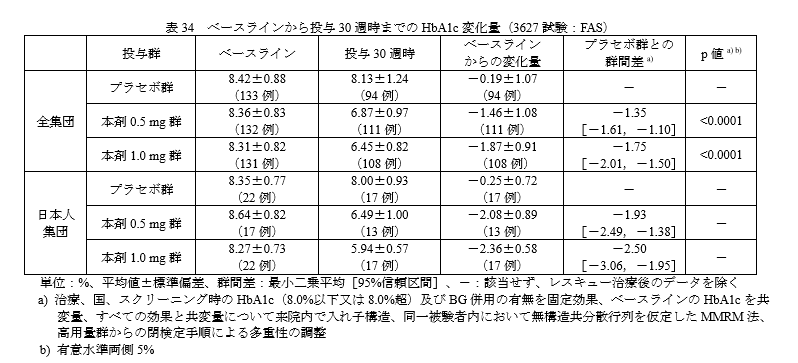
オゼンピック群とプラセボ群の群間差の95%信頼区間の上限が 0 を下回ったことから、プラセボ群に対するオゼンピック群の優越性が示されました。

以上、主要な4つの試験結果から、オゼンピックの単独療法・併用療法いずれの有効性について確認された、と判断されています。
オゼンピック vs トルリシティ(SUSTAIN7)
審査報告書には記載がありませんが、2018年のLancetに
オゼンピックとトルリシティのガチンコ対決論文が掲載されています。

対象:18歳以上で、メトホルミン単剤療法でのHbA1cが7.0-10.5%の2型糖尿病患者
デザイン:非盲検並行群間比較第試験(オゼンピック0.5mg, 1mg、トルリシティ0.75mg, 1.5mgを1:1:1:1に割付)
主要評価項目:40週時のHbA1cパーセンテージのベースラインからの変化
副次評価項目:40週時の体重の変化
結果です。

この試験はノボが主体で行っているので研究者側のバイアスがありますが、主要評価項目であるHbA1c低下率ではオゼンピックに軍配があがっています。
また、体重減少もオゼンピックで有意な差が認められています。

ガチンコ対決で勝利しているので、トルリシティからオゼンピックへの切り替えが増えていくかも。
安全性

2020年7月5日時点のRMPです。
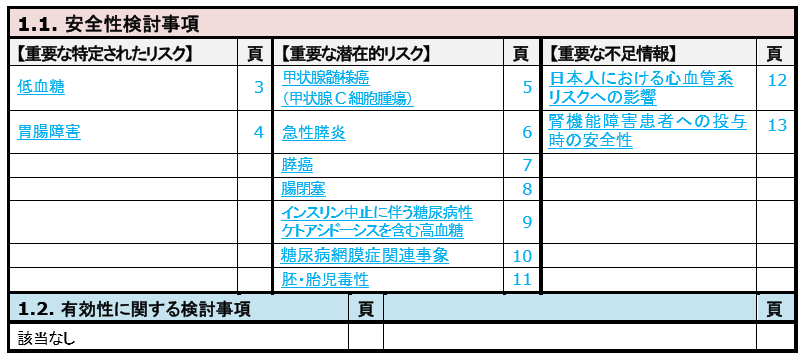
低血糖
SU及びインスリン併用時に低血糖の発現が多い傾向が認められた、とあります。
一方、単独療法及びその他の糖尿病薬との併用療法では低血糖のリスクは高くない、とされています。
胃腸障害
胃腸障害には、悪心、下痢、嘔吐、便秘、消化不良、腹部不快感が含まれています。
下痢、悪心の持続期間は3-8日で短期で収束するようですが、便秘は19-169日、腹部不快感5-144日と幅があり、長期に渡る副作用と思われます。
膵炎
膵炎自体の発現頻度はほとんどありませんでした。
リパーゼ又はアミラーゼ増加の程度はほとんどが基準値上限の2倍未満でした。
オゼンピック群のみで膵酵素値の増加が認められているため、潜在的なリスクに分類されています。
糖尿病網膜症
心血管アウトカム試験である海外第 III 相 CVOT 試験(3744 試験)では、糖尿病網膜症に関連する合併症を発現した被験者の割合は、試験開始直後から及び試験中を通じて継続的にプラセボ群と比較してオゼンピック群で高かった〔ハザード比:1.76(95%信頼区間:1.11; 2.78)、p=0.0159〕という結果でした。
しかし、それ以外の試験ではそのリスクが示されていないため、機構は糖尿病網膜症がオゼンピック投与時のリスクなのか、既往歴等に関連するのか必ずしも明確にはなっていないとして、潜在的リスクに分類しています。
甲状腺C細胞腫瘍
発がん性リスクの上昇を示唆する所見は認められていませんが、非臨床毒性試験で甲状腺C細胞腫瘍の発現が認められているため、潜在的リスクに分類されています。
胚・胎児毒性
機構は、生殖発生毒性試験で認められた胚・胎児毒性が最大臨床用量投与時の曝露量を大きく下回る曝露量で発現していることから、添付文書において適切に情報提供を行う必要があると考える、として潜在的リスクに分類しています。
注射部位反応・アレルギー反応
注射部位反応に関連する事象の発現は少なく、臨床的に問題となる可能性は低いとされています。
アレルギー反応に関しては、重症度のほとんどは軽度ですが、重篤な例も認めているため製造販売後も情報収集に努める必要がある、と記載があります。
いずれもRMPにも記載はありません。
腎機能障害時の投与量
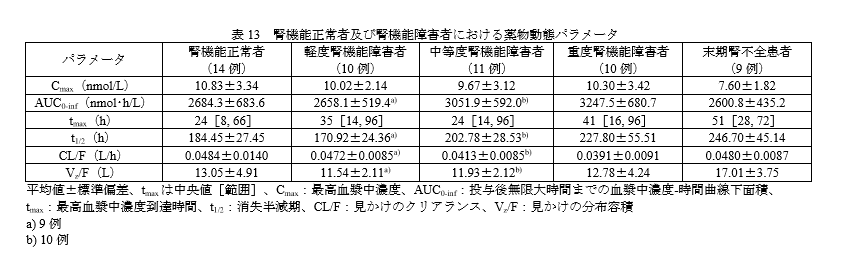
腎障害の程度による薬物動態パラメータに大きな変化はなさそうです。
臨床試験でも中等度までの腎機能の程度による有害事象の変化は認められていませんので、Ccr30ml/min/1.73㎡までは基本的に減量せずに使用可能と思われます。
ただし、重度腎機能障害及び末期腎疾患を有する患者のデータは限られるため、重要な不足情報となっています。

類薬ではビデュリオンで急性腎不全が特定されたリスクになっていますので、トルリシティ同様、腎機能の面での差別化ができますね。
肝機能障害時の投与量
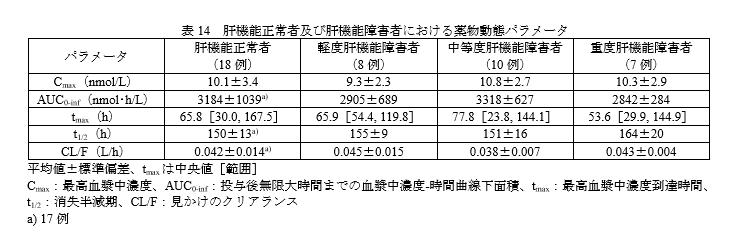
肝機能障害の程度による薬物動態パラメータに大きな変化はありません。
臨床試験でも、肝機能障害の有無によって有害事象の発現割合が大きく異なる傾向は認められていませんので、Child-Pugh分類による投与量の調節は必要はないと思われます。
相互作用
オゼンピックとアトルバスタチンの併用で、アトルバスタチンの代謝物であるp-ヒドロキシアトルバスタチンのAUCが2.08倍になるとの記載があります。
アトルバスタチンの代謝物のメインはオルト体のようなので臨床的に問題になることはないようです。
また、オゼンピックは胃内容物排泄遅延作用を持ちますが、各種薬剤との併用試験の結果、臨床的に問題となるような薬物相互作用はないとされています。
投与タイミング
投与予定日にオゼンピックができなかった場合、次回投与日までの日数は5日以内であれば投与可能とされています。
添付文書では、
投与を忘れた場合は、次回投与までの期間が 2日間(48時間)以上であれば、気 づいた時点で直ちに投与し、その後はあらかじめ定めた曜日に投与すること。
オゼンピック皮下注SD 添付文書より
次回投与までの期間が 2日間(48時間)未満であれば投与せず、次のあらかじめ定めた曜日に投与すること。
なお、週1回投与の定めた曜日を変更する必要がある場合は、前回投与から少なくとも 2日間(48時間)以上間隔を空けること。

多少のタイミングのずれは問題ないということですね。
臨床的位置づけ

2020年7月時点で使用できるGLP-1作動性の注射薬は以下のとおりです。
・ノボ ビクトーザ(リラグルチド)
・リリー トルリシティ(デュラグルチド)
・アストラゼネカ バイエッタ、ビデュリオン(エキセナチド)
・サノフィ リキスミア(リキシセナチド)
オゼンピックの特徴の一つとして、用量漸増法を用いて維持用量に到達させることから、患者個々の忍容性を確認しながら増量でき、GLP-1受容体作動薬に共通する事象として知られる胃腸障害の有害事象の軽減につながる、ことが挙げられています。
また、オゼンピックとDPP-4阻害薬の併用は規定されていませんが、作用機序が類似しており、臨床試験での有効性・安全性は不明であることから、現時点では医療現場で推奨される組合せとして想定されません。

以下、RMPの違いをまとめてみました。

単純に比較はできませんが、オゼンピックは
・注射部位反応のリスクが少ない
・用量調節によって胃腸障害が軽減できる可能性がある
・Ccr30ml/min/1.73㎡までは腎機能での調節が必要なさそう
といったメリットは売りですね。
(このあたりは今後のRMPの改訂で変わるかもしれませんが)

SUSTAIN7の結果からは、しっかりとした効果を狙いたい場合はオゼンピックが優位になってきそうです。
逆に体重減少がリスクになる高齢者や非肥満患者の場合はオゼンピックを避ける必要があるかも。
あとは投与回数、デバイス、副作用の忍容性で選択していくことになります。
まとめ
なかなかボリュームがあって大変でしたが、オゼンピックの特徴についてまとめてみました。
セマグルチドは経口薬も承認されたようですので、今後は使い分けの選択肢が広がりますね。
・オゼンピックは週1回のGLP-1作動薬
・単独療法でも経口DM薬、インスリンとの併用療法でも有効性が確認されている
・トルリシティに比べて効果が高いことが検証されている(SUSTAIN7)
・副作用の忍容性の高さから今後GLP-1作動薬の主流になるかも
新薬の勉強をするのに参考になる書籍です。添付文書について丁寧に解説されており、医薬品情報の知識を深めるにはおススメの一冊です。
新薬の評価についてはこちらの記事もどうぞ
薬剤師に必要なスキル~新薬を評価する方法~





コメント