このページの要点は以下のとおりです。
・審査報告書は添付文書やインタビューフォーム以上の情報が詰まっている
・薬の副作用のプロファイルを知るにはRMPをみるのが早い
・RMPでは特定されたリスク、潜在的リスク、重要な不足事項が分かる
・実際に審査報告書に目をとおして薬の評価をしてみると薬剤師のスキルアップに
みなさんは新薬が発売になったとき、その薬についての情報はどのように得ていますか?
添付文書?
インタビューフォーム?
製薬会社主催の勉強会?
MRさんからの情報?
今はインターネットでたくさんの情報が得られるので、ネットで情報を得ている方も多いと思いますし、病院の医薬品情報室では国内外の論文やガイドラインを参考にして医薬品の評価を行っている施設もあります。
管理人自身は新薬についての情報を得るときは審査報告書や医薬品リスク管理計画(RMP)を参考にしています。

今回は管理人が実際にどのように審査報告書とRMPを活用しているかについて解説します。
審査報告書とRMP

審査報告書とは
まず審査報告書について説明します。
審査報告書は、医薬品の承認を得るために製薬企業が提出したデータに対して、医薬品医療機器総合機構(PMDA)が審査するというやりとりを記載した文書です。
医薬品が承認に至るまでの過程がまとめられており、大抵100ページ以上の膨大な資料になっています。

添付文書やインタビューフォームは医療従事者が知っておくべき必要最小限の内容にまとめられています。
審査報告書は、試験の背景やデータの解釈について詳しく記載されているので、承認に至った裏側の事情が分かるんです。
審査報告書の構成
審査報告書は、審査報告(1)と審査報告(2)から構成されています。
審査報告(1)
製薬企業から提出されたデータ(品質、薬理、薬物動態、毒性、臨床薬理、治験など)の概要について、製薬企業側(申請者)とPMDAが議論し、PMDAが判断した結論が記載
審査報告(2)
外部専門家の意見もふまえて行われた、有効性と安全性に関する議論の結果が記載

ほとんどが審査報告(1)で、審査報告(2)は最後の数ページしかないんです。RMPも審査報告(2)に記載されています
RMP(医薬品リスク管理計画)とは

RMPは簡単にいうと、医薬品の開発から市販後まで一貫したリスク管理をまとめた文書のことです。
RMPは医薬品ごとに製薬企業がPMDAに提出します。
副作用の中で重要なものを
・「重要な特定されたリスク」
・「重要な潜在的リスク」
・「重要な不足情報」
の3つのカテゴリーに分類しています。
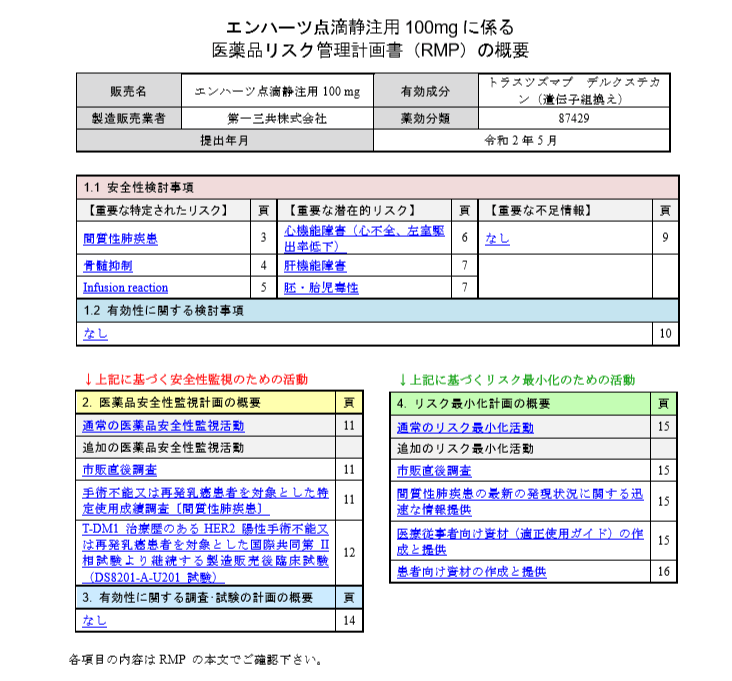
治験の段階では薬のすべてのリスクを把握することは困難なので、疑わしいものや分かっていないものも含んでいます。
薬の副作用のプロファイルを知りたいときはRMPを見るのが効率的です。
また、
市販後に実施する情報収集活動(市販直後調査や製造販売後データベース調査)
医療従事者への情報提供
患者向け資材作成
といった活動についてもまとめられています。
入手の仕方
PMDAのホームページから入手できます。
https://www.pmda.go.jp/
①まず「医療用医薬品」をクリックします。
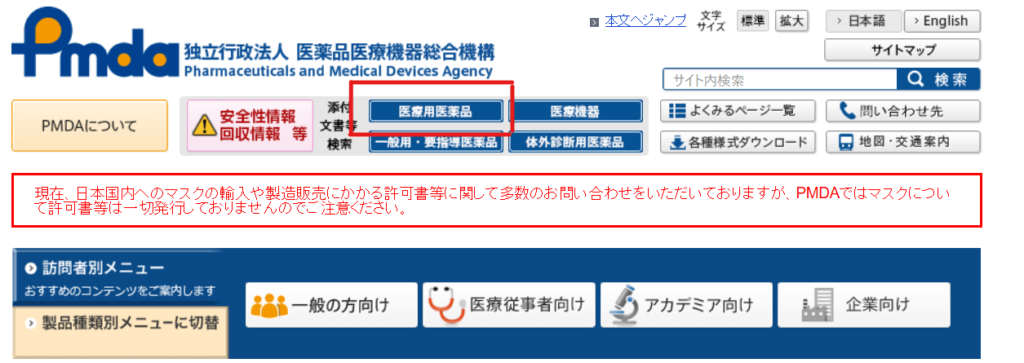
②医薬品名(商品名でも一般名でも可)を入力します。
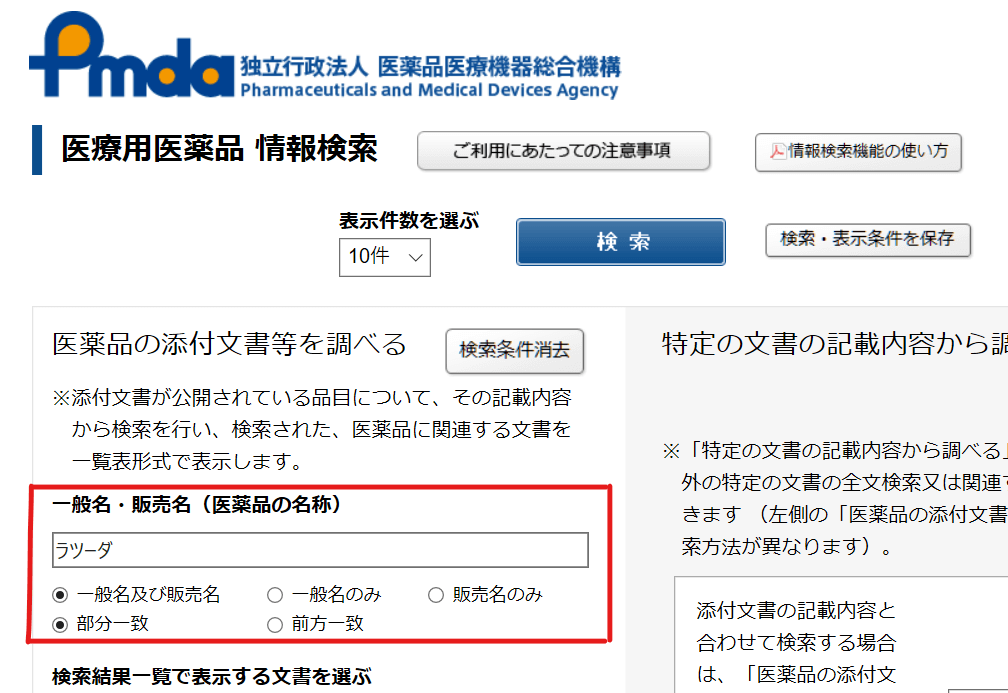
③検索結果の一番右までスクロールすると、RMPと審査報告書が見れます。


これでダウンロードできたね!
審査報告書を見るときのポイント

前述したとおり、審査報告書は膨大です。
初心者はまず、「審査報告(2)」と「RMP」からみていくと良いと思います。
①「審査報告(2)」
機構や専門家が最終的にどう評価したのかの要点が確認できる
② RMP
特定されたリスクと潜在的なリスク、不足している情報が確認できる
時間があれば、「審査報告(1)審査の概略」に目をとおしていきます。
審査の概略では「申請者は、、」「機構は、、」という特徴的な記載があります。

このやりとりのあとに、「機構は以下のように判断した」、というくだりがありますのでそこを重点的に読むといいと思います。
審査報告書・RMPの注意点
審査報告書の記載内容は承認申請、審査時点のものです。最新の情報があればそちらを優先にする場合もありえます。
また、RMPは市販後調査の結果によって追記・変更されることがあります。
定期的にチェックしておくとよいでしょう。
ちなみにアビガンは承認申請されましたが、結局インフルエンザ治療薬として日の目を見ることはありませんでした。
審査報告書でメッタ斬りにされていますので一度ご覧ください。
【関連記事】アビガンの効果が期待されているのは「作用の仕組みが新しい」から
まとめ
このように薬の評価は、MRさんからの情報提供や勉強会がなくても薬剤師自らの手で行うことができます。
個々の能力によって見る視点は異なるので評価する基準も変わってくるとは思いますが、いくつか読んでいくうちに自分なりの発見や疑問点がでてくるはず。
それが、まさに自分なりに評価する力がついているということです。
医薬品の評価は薬剤師の専門性です。
ご自身のキャリアアップのために、受け身でなく能動的に医薬品情報を収集するスキルを身につけてみてはいかがでしょうか?
今回参考にした書籍はこちら。



コメント