このページの要点は以下のとおりです。
・ビルテプソは日本で開発されたアンチセンス核酸医薬品
・デュシェンヌ型 筋ジストロフィーに対しての有効性が証明された
・特定されたリスクはないが、症例数が少ないため市販後のデータ蓄積が必要

筋ジストロフィーって聞いたことあります。

神経難病とされている非常にめずらしい病気です。
使う施設もごくわずかなので、実際に関わることはほとんどないとは思いますが、画期的な新薬なので紹介しますね。
ビルテプソ(ビルトラルセン)は「デュシェンヌ型筋ジストロフィー」という疾患に使用されます。
まずはどんな疾患か確認していきましょう。
筋ジストロフィーとは?

筋ジストロフィーとは骨格筋の 壊死 ・再生を主病変とする遺伝性筋疾患の総称です。筋ジストロフィーの中には多数の疾患が含まれますが、いずれも筋肉の機能に不可欠なタンパク質の設計図となる遺伝子に 変異 が生じたためにおきる病気です。遺伝子に 変異 が生じると、タンパク質の機能が障害されるため、細胞の正常な機能を維持できなくなり、筋肉の 変性 壊死 が生じます。その結果筋萎縮や脂肪・ 線維化 が生じ、筋力が低下し運動機能など各機能障害をもたらします。
https://www.nanbyou.or.jp/entry/4522 難病情報センターホームページより
筋ジストロフィーは、臨床症状の特徴や発症年齢、遺伝形式等に基づいて7つの型に分類されます。
このうちの1つの型がデュシェンヌ型 筋ジストロフィーです。
デュシェンヌ型筋ジストロフィー(DMD)
DMDは、ジストロフィンというタンパク質が、遺伝子の異常によって正常に作られなくなることで発症する遺伝性疾患です。
ジストロフィンは基底膜と筋細胞の細胞骨格を固定しており、天井と柱を支える梁のような役割を果たしています。
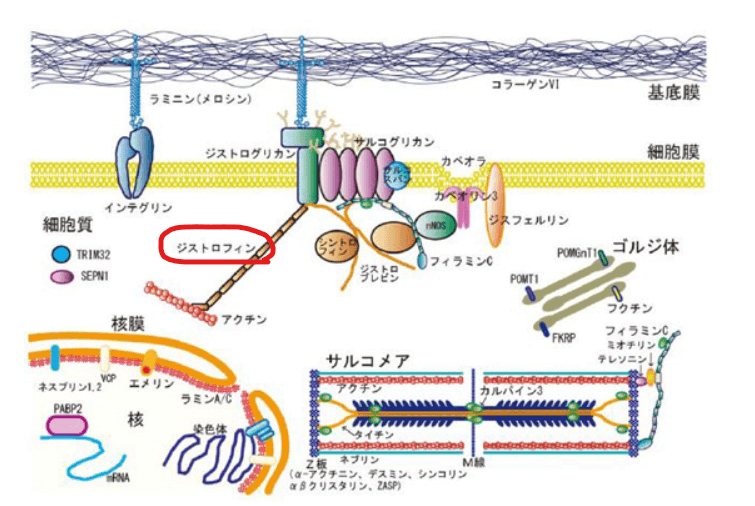
ジストロフィンが欠損することにより、筋細胞膜が筋収縮によるダメージを受けやすくなり、筋細胞死や炎症・筋の線維化・筋機能の低下が進みます。
DMDの特徴

DMDでは、呼吸筋や心筋の障害、さらには重篤な運動機能障害、嚥下障害、痰の詰まり、消化管障害等が進行性に起こります。
疫学調査では10歳頃に歩行不能となり、平均寿命は約30歳とされています。

新生男児の3500人に1人が罹患し、日本国内における患者数は約5000人と推計されています。
治療薬としては、
・プレドニゾロン
(効能・効果は「デュシェンヌ型筋ジストロフィー」)
・アデノシン三リン二ナトリウム水和物(ATP)の注射剤
(効能・効果は「筋ジストロフィー症及びその類縁疾患」)
がありますが、主体はプレドニゾロンで、理学療法などのリハビリテーションと組み合わせて治療を行います。
ビルテプソの特徴

ビルテプソは、「アンチセンス核酸」と呼ばれる比較的新しい作用機序をもつ薬剤です。

ビルテプソは日本新薬さんと国立精神・神経医療研究センター(NCNP)で共同創製し、日本新薬で開発されたくすりだそうです。
同系統の核酸医薬品としては、脊髄性筋萎縮症治療薬の「スピンラザ」、加齢黄斑変性治療薬の「マクジェン」があります。
詳しい機序は、エクソン・スキッピングと呼ばれる作用です。
エクソン・スキッピング作用とは
遺伝子の転写産物(メッセンジャーRNA)のうち、タンパク質に翻訳される領域(エクソン)の一部を人為的に取り除く(スキップする)ことで、アミノ酸の読み取り枠のずれを修正する治療法です。

なんだか難しい・・

要は、遺伝子の異常が起こっている部分をごっそり取り除いたタンパク質ができるようにくすりで操作してる、ということです。
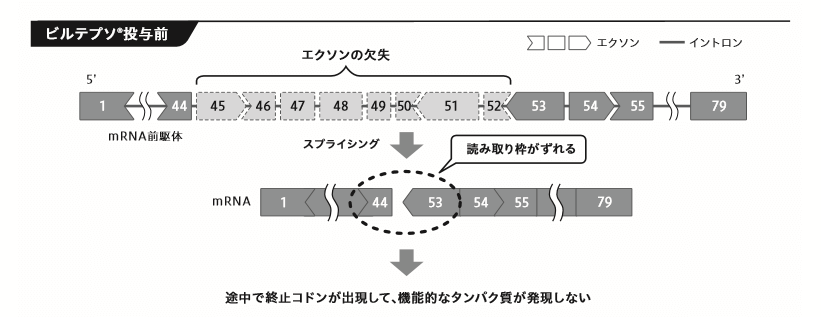
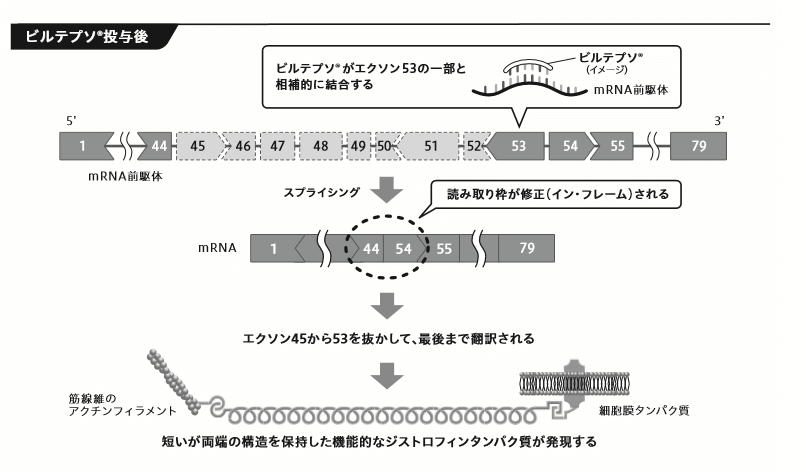
ということで、ビルテプソの効能効果は
「エクソン53スキッピングにより治療可能なジストロフィン遺伝子の欠失が確認されているデュシェンヌ型筋ジストロフィー」
実際の投与対象患者は約400人と推計されています。
なお、2020年3月時点において、承認されている国又は地域はありません。
有効性

海外第Ⅱ相試験(201試験)を参考にしています。
対象:エクソン53スキッピングにより治療可能なジストロフィン遺伝子の欠失が確認されている、4歳以上10歳未満の外国人DMD男児患者(16例)
デザイン:プラセボ対照無作為化二重盲検並行群間比較試験
主要評価項目:筋生検によるジストロフィンタンパク発現(ウェスタンブロット法)のベースラインからの変化
副次評価項目:ベースラインからの時間機能検査[10メートル歩行/走行時間、立ち上がり時間、6分間歩行距離、ノース・スター歩行能力評価、4段階段昇り時間]の変化
結果です

ビルテプソ40mg/kg群、80mg/kg群ともに、ジストロフィンタンパク発現はベースライン時と比較して統計学的に有意に増加していました。
また副次評価項目についても
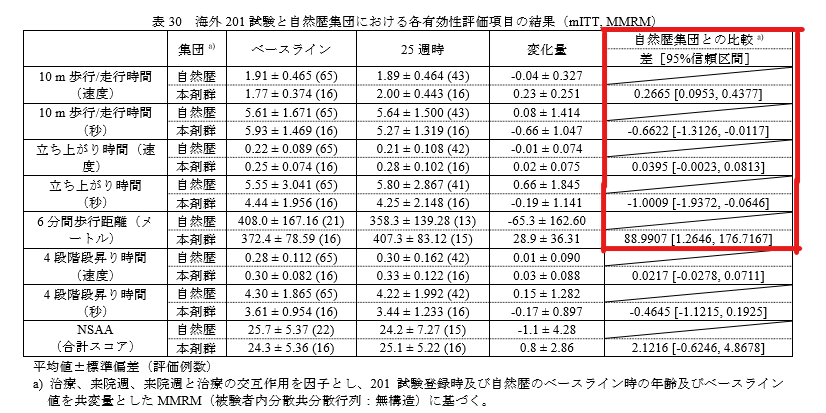
10メートル歩行/走行時間、立ち上がり時間、6分間歩行距離で、自然歴集団と比較してビルテプソ群で改善が認められました。
安全性

RMPです。

特定されたリスクに該当するものはありません。
潜在的リスクとしては
過敏症:臨床試験では認めていないが、他の核酸医薬品では過敏症の発現が報告されているため
腎機能障害:臨床上問題となる可能性は低いが、腎排泄型薬剤であるため
尿管における移行上皮癌:マウスで認められており、ヒトでのリスクが明確でないため
が挙げられています。

ちなみに、ビルテプソの投与24時間後までの尿中排泄率は90%以上で、ほとんどが未変化体として排泄されている(審査報告書P24)ことから、腎排泄型薬剤であることがわかります。
その他の副作用としては、RMPにはありませんが、審査報告書内で、
類薬のeteplirsenの臨床試験で平衡障害の有害事象の発現を認めているため、中枢神経系の有害事象に関する情報を収集する必要がある、と記載があります。
臨床的位置づけ

以下の点で、ビルテプソは
「エクソン53スキッピングにより治療可能なジストロフィン遺伝子の欠失が確認されているDMD患者」
に対する新たな治療の選択肢とされています。
・ステロイド治療は、DMD の長期的な予後の改善に関するエビデンスが乏しいことや、肥満等の副作用に留意する必要がある
・アデノシン三リン酸二ナトリウム水和物が「筋ジストロフィー症及びその類縁疾患」の適応を有するが、現在ではほとんど使用されていない
・海外では、2016年9月米国において本剤と同じモルフォリノ核酸であるeteplirsenがエクソン51スキッピングで治療可能なDMDを適応症として承認
また、2019年12月にgolodirsenがエクソン53スキッピングで治療可能なDMDを適応症としてに迅速承認されている
また、2014年8月に欧州においてナンセンス変異のリードスルーを誘導する低分子医薬品であるatalurenが、ナンセンス変異型DMDを適応症として条件付き承認されている
なお、海外の診療ガイドラインにおいて、これらの薬剤は現時点では記載されていない。また、これらの薬剤は本邦において承認されていない

海外のくすりとの差別化は不明ですが、これまでは海外のくすりを使いたくても使えなかった患者さんも、これで保険適応で使えるようになりました。
一部の遺伝子欠損では有効性が減弱する可能性が指摘されています。
・45-52欠失及び49-52欠失患者、歩行不能の患者において本剤の有効性が減弱する可能性が示唆されている
・43-52欠失患者について、投与経験がないものの、作用機序の観点から一定の有効性は期待できること、他のエクソン欠失患者と同様に治療薬が限られ、極めて希少かつ重篤な疾患であることから、投与対象に含めることは可能である。
また、DMDは男性がほとんどの割合を占めますが、極めてまれに女性にも発症することが知られています。
しかしながら、現時点ではビルテプソは男性のみの投与に限られています。
・正常なX染色体を有する女性保因者について、本剤の効能・効果の対象外であるため治療対象外
女性DMD患者への投与について、女性DMD患者は極めてまれに存在することが説明されているものの、本剤の非臨床試験は雄動物のみを対象としており、臨床試験においても女性患者への投与経験はないことから、添付文書において注意喚起を行うことは適切である。
まとめ
・ビルテプソは日本で開発されたアンチセンス核酸医薬品
・デュシェンヌ型 筋ジストロフィーに対しての有効性が証明された
・特定されたリスクはないが、症例数が少ないため市販後のデータ蓄積が必要

おそらく私がこのくすりに直接かかわることはないと思いますが、筋ジストロフィーについての知識を深めることができて勉強になりました。
開発に携われた方々に敬意を表したいと思います。
新薬について自分で勉強してみたい、医薬品の評価をしてみたい人にはこちらの本がおすすめです。初心者にも分かりやすいですよ。






コメント